
有助于攻克罕见疾病和设计新的基因疗法。
1月29日,谷歌 DeepMind 团队 的研究成果再次登上顶级学术期刊《自然》(Nature)的封面。这次的主角是一个名为 AlphaGenome 的统一DNA序列预测模型。
许多常见的家族遗传病,比如心脏病、自身免疫性疾病以及一些精神健康问题,其根源都与影响基因调控的DNA突变有关,许多癌症病例也是如此。然而,要精准定位究竟是哪些基因缺陷导致了这些疾病,一直是生物医学领域的一项艰巨挑战。
AlphaGenome的出现,为科学家提供了一把强有力的新钥匙。利用这一模型,研究人员有望预测特定突变会如何干扰基因的正常调控方式,从而更准确地识别疾病的遗传驱动因素。这对于诊断病因不明的罕见遗传病,以及设计全新的基因疗法,都具有里程碑式的意义。

统一DNA序列模型AlphaGenome
据了解,AlphaGenome模型能够以长达100万碱基对的DNA序列作为输入,并在多种分子模态下,以单碱基的分辨率预测数千种功能组学信号图谱。这些预测模态覆盖了基因表达、转录起始、染色质开放状态、组蛋白修饰、转录因子结合、染色质相互作用图谱、剪接位点利用率以及剪接接点的坐标与强度。
该模型基于人类和小鼠的基因组数据完成训练。在涉及变异效应预测的26项基准评估中,AlphaGenome在25项上的表现达到甚至超越了当前性能最优的外部模型。

多模态解读基因组序列变异
AlphaGenome被广泛视为DeepMind旗下明星模型AlphaFold的重要后续。AlphaFold曾因能够根据氨基酸序列高精度预测蛋白质三维结构而荣登2021年《自然》封面,其核心贡献者也在2024年荣获诺贝尔化学奖。2023年,DeepMind还发布了专注于预测蛋白质编码区错义突变影响的AI工具AlphaMissense。
与前辈们相比,AlphaGenome的一项关键进步在于,它能够对极长的基因组序列的功能做出目前最准确的预测。这得益于它将多模态预测、长序列上下文分析与单碱基分辨率整合到了同一个深度学习框架之中。
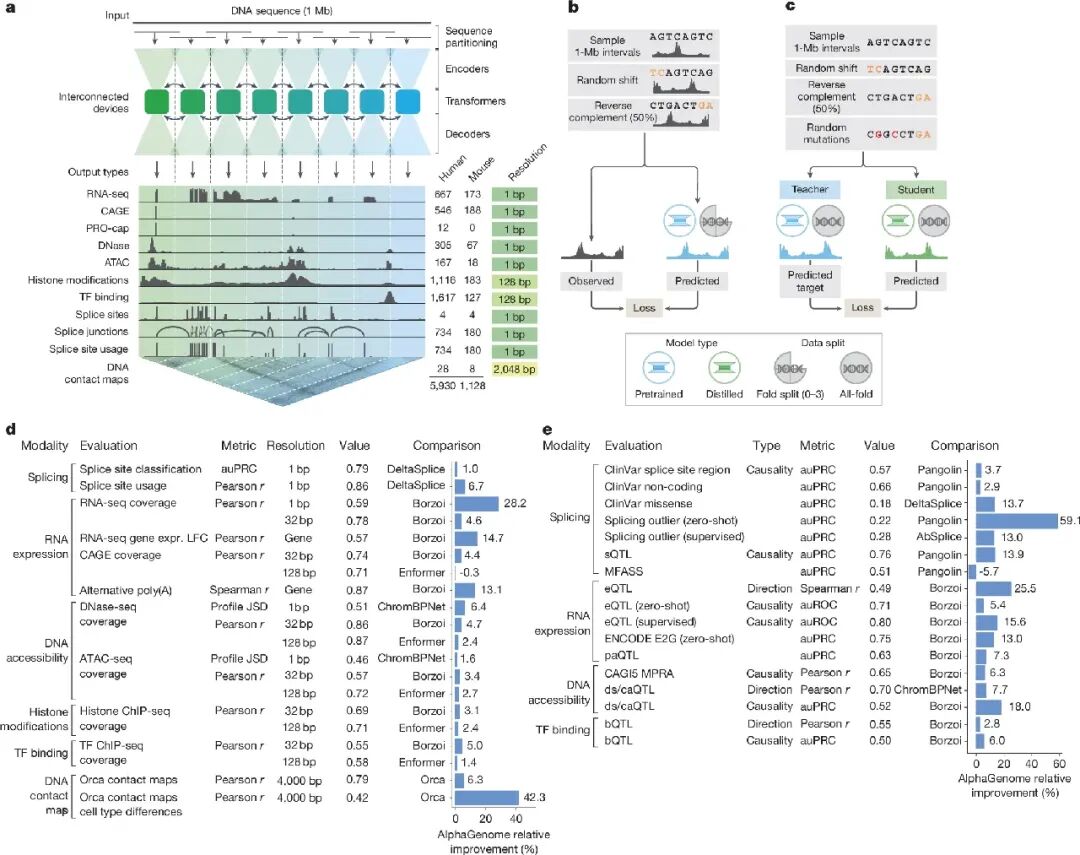
AlphaGenome模型架构、训练方案和综合评估性能
解读基因组序列变异的影响,尤其是位于蛋白质编码区之外的 非编码变异 所产生的复杂分子效应,是当前生物学领域的核心挑战之一。人类基因组中超过98%的已知遗传变异都属于非编码变异,其解读难度极高。
现有的基于深度学习的序列-功能模型,通常面临两个根本性的权衡问题:
- 受限于计算资源,模型往往难以兼顾 捕获长距离基因组互作 与 实现单核苷酸水平的高分辨率预测。
- 在 覆盖多样化的预测模态 与 专攻单一或少数模态以追求极致性能 之间需要取舍,因此许多顶尖模型都高度聚焦于单一任务。
AlphaGenome模型的设计,正是为了突破这些瓶颈。它以1兆碱基(1 Mb)的DNA序列为输入,能够针对多种细胞类型,预测包括基因表达、剪接模式、染色质特征和三维接触图谱在内的多样化基因组信号,为解析基因组的调控密码提供了一个高效且可扩展的核心工具。

基准测试达最先进水平
对于AlphaGenome的研究成果登上《自然》封面,谷歌CEO桑达尔·皮查伊(Sundar Pichai)在社交媒体上表达了自豪之情。他透露,该模型的API自推出以来,已收到来自全球160多个国家和地区的超过100万次调用请求,显示出科研界对这项工具的高度需求和认可。
根据谷歌官方博客信息,AlphaGenome于2025年6月25日首次推出。它不仅能够预测数千种表征基因调控活性的分子特性,还能通过比较突变序列与未突变序列的预测结果,高效评估基因变异或突变的具体影响。
AlphaGenome的架构首先使用卷积层来检测基因组序列中的短模式,随后利用 Transformer 层在序列的所有位置之间传递全局信息,最后通过一系列输出层将检测到的模式转化为不同模态的预测结果。在训练过程中,针对单个长序列的计算会被分配到多个互连的张量处理单元(TPU)上并行处理,以应对巨大的计算需求。

与现有的DNA序列模型相比,AlphaGenome具备以下独特优势:
1. 高分辨率的长序列上下文分析
长序列上下文对于覆盖远距离调控基因的区域(如增强子)至关重要,而碱基级别的分辨率对于捕捉精细的生物学细节(如转录因子结合位点)同样关键。AlphaGenome实现了两者的统一。
2. 综合的多模态预测能力
通过对长序列输入进行高分辨率预测,AlphaGenome能够一次性输出种类繁多的模态结果,为科学家提供关于基因调控复杂步骤的更全面、集成化的信息视图。
3. 高效的变异影响评分
除了预测多种分子特性外,AlphaGenome还能在一秒内高效地评估单个基因变异对所有预测特性的影响,并生成总结性的对比报告,极大地提升了研究效率。
4. 创新的剪接连接点建模
许多罕见遗传疾病,如脊髓性肌萎缩症和某些类型的囊性纤维化,都可能由RNA剪接错误引起。AlphaGenome首次能够直接从序列数据中显式地模拟剪接连接点的位置和表达水平,从而更深入地了解基因变异对RNA剪接过程的影响。
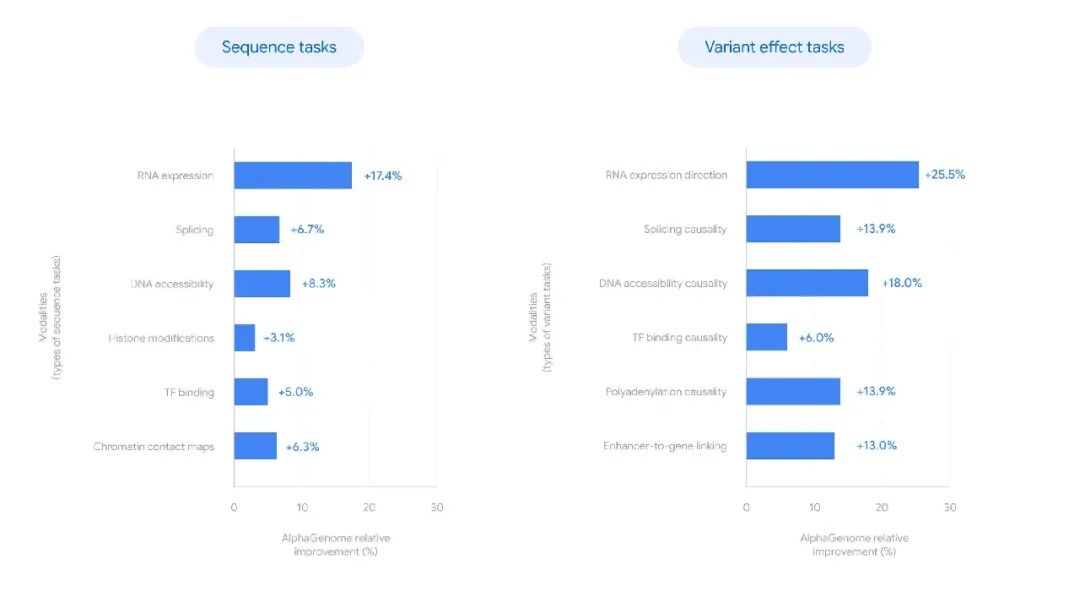
广泛的基因组预测基准测试表明,AlphaGenome的性能达到了最先进水平。这一工具有望推动多个研究方向,例如罕见疾病的机制认知、合成生物学设计、分子生物学探索以及基础生命科学研究。
研究人员在论文结论中也指出了模型目前的局限。AlphaGenome主要预测变异的分子层面效应,而复杂的生物表型(如某种疾病)往往涉及更广泛的生物学过程,包括基因功能、发育程序、环境因素以及最终的致病效应,这些可能超出了模型直接的序列-功能预测范畴。
此外,与所有基于序列的模型一样,如何更准确地捕捉超长距离(例如超过10万碱基对)调控元件的影响,仍然是一个持续性的挑战。未来的另一个工作重点,是进一步提高模型捕捉细胞和组织特异性模式的能力,使其预测更具针对性和实用性。

封面文章幕后的华人力量
值得注意的是,在这篇《自然》封面文章的核心作者列表中,出现了一位华人科学家的名字:Jun Cheng。
本期封面论文的核心作者们围绕这款统一的DNA预测模型展开了深入探讨,详细剖析了AlphaGenome背后的科学原理、研发过程中遇到的技术挑战,以及广阔的未来应用前景。


Jun Cheng 目前是谷歌DeepMind的研究科学家,专注于运用先进的机器学习技术解析人类基因组。他曾是AlphaMissense项目的主导者之一,该项目致力于解析致病遗传变异的功能意义。同时,他也是AlphaGenome项目的主要作者。
Jun Cheng在慕尼黑工业大学计算生物学实验室获得博士学位。他的研究兴趣广泛,主要集中在训练基因组学基础模型以应对该领域的各项关键挑战。此前的研究工作也包括构建基于序列的模型来阐明核心生物学机制,以及预测编码和非编码变异的影响。
许多科学家认为,AlphaGenome是该领域的一个里程碑。这种方法为未来提供了一个灵活且可扩展的架构。通过扩展训练数据(如纳入更多物种或其他模态),模型的功能和性能可以持续得到提升,使其能力更加全面,不断拓展我们对生命密码的理解边界。